HATÓANYAG NEVE, KÉPLETE, MEGJELENÉSI FORMÁJA | |
Név IUPAC név | acetonitril, metil-cianid, cianometán, etánnitril, metánkarbonitril [1], [3], [10] acetonitrile [1] |
Vegyületcsoport | szerves nitril-származék [1] |
CAS szám | [75-05-8] [8] |
Molekulaképlet | C2H3N (CH3CN) [1] |
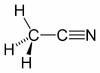
Szerkezeti képlet | [kép] |
Megjelenés | színtelen, enyhe szagú folyadék [1] |
ALKALMAZÁS, HATÁSOK | |
Alkalmazás, | Az acetonitril számos vegyület kiváló oldószere, ezért a legnagyobb mennyiségben a vegyipar használja. Gyógyszergyártásban, butadién tisztításában és a filmgyártásban van nagy jelentősége. Továbbá alacsony a viszkozitása és a reaktivitása is. Ezen és előbb említett tulajdonságai miatt igen elterjedten alkalmazzák műszeres analitikai (HPLC, ciklikus voltametria) vizsgálatokban. Az acetonitril két szénatomos építőelem szerves vegyipari szintézisekben, például növényvédőszerek és illatanyagok előállításánál. Klórciánnal való reakciójában malonitril képződik.[1]
Kémiai alapkutatásban átmenetifémekkel alkotott komplex vegyületei is említést érdemelnek. Ilyen például a palládium-dikloriddal alkotott vegyülete: PdCl2(MeCN)2, amely közvetlenül képződik PdCl2 és MeCN reakciójában.[1] |
Elsődleges hatás | Maga az acetonitril csak mérsékelten mérgező. [1] |
Mellékhatások | Az emberi szervezetbe jutva és ott metabolizálva hidrogén-cianid szabadul fel, amely aztán felelős a mérgezési tünetekért. [1] |
FIZIKAI-KÉMIAI TULAJDONSÁGOK | |
Moláris tömeg | 41,05 g·mol−1 [1] |
Sűrűség | 0,786 g/cm3 folyadék [4] |
Olvadáspont | -45,7 °C [3] |
Forráspont | 81,6 °C (1013 hPa) [2] |
Gőznyomás | 9,7 kPa (20 °C) [2] |
Vízoldhatóság | Vízzel jól elegyedik. [3] |
Stabilitás | Szobahőmérsékleten stabil de illékony, igen poláros oldószer. EU osztályozás szerint gyúlékony és ártalmas vegyület. [1] |
Hidrolízis | Savas vagy bázikus körülmények között hidrolizál. [7] |
Fizikai, kémia, biológiai állandók | |
H, Henry-állandó | 2,91 Pa·m3·mol-1 [11] |
Kow | 0,46 (log Kow = -0,34) [6], [9] |
Koc [l/kg] | 16 [11] |
pKa | 29,1 [9] |
BCF, biokoncentráció | 0,3 l/kg [5] |
VISELKEDÉSE A KÖRNYEZETBEN | |
Abiotikus degradálhatóság és | - |
Biodegradálhatóság és | BOD5: 0,17g O2/g [5] Biodegradálhatóság vízben (konc: 0,1-25 mg/l): 20% (5 napos) 40% (12 napos) [5] |
KÖRNYEZETMINŐSÉGI KRITÉRIUMOK | |
Határértékek | Levegő: 410ppm [12] |
MÉRT KONCENTRÁCIÓJA A KÖRNYEZETBEN | |
Koncentrációja a környezetben (mérési adat) | Log POV <1 (bioakkumulációs potenciál) [9] Felezési ideje vízben: 676 nap [11] Felezési ideje levegőben: 535-860 nap [11] |
ÖKOSZISZTÉMÁRA GYAKOROLT HATÁS | |
Vízi ökoszisztémára gyakorolt hatások |
|
Akut toxicitási adatok (LC50, EC50) | 48 órás LC50: 730 mg/l (Cyprinus carpio) [11] 72 órás EC50: 7300 mg/l (alga) [6] 24 órás EC50: >1000mg/l (Daphnia Magna) [6] |
Krónikus toxicitási adatok (NOEC, LOEC) | - [6], [9] |
Szárazföldi ökoszisztémára gyakorolt hatások |
|
Akut toxicitási adatok (LC50, EC50) | 4 órás LC50: 27 mg/l (patkány) [6] |
Krónikus toxicitási adatok (NOEC, LOEC) | - [6], [9] |
EMBERRE GYAKOROLT HATÁS | |
Általános káros hatások | Maga az acetonitril csak mérsékelten toxikus, néhány órával az expozíciót követően nehéz légzés, alacsony pulzus, hányinger, hányás és rángatódzás észlelhető. Súlyosabb esetben kómás állapot is létrejöhet, amelyet a halál követhet légzésbénulás következtében. A mérgezést szenvedett személyt úgy kell elsősegélyben részesíteni, mintha ciánmérgezése lenne. Tiszta oxigén lélegeztetése, valamint nátrium-nitrit vagy nátrium-tioszulfát injektálása intravénásan. [1] |
Lebontás az emberben, távozása a szervezetből | Az emberi szervezetbe jutva és ott metabolizálva hidrogén-cianid szabadul fel, amely aztán felelős a mérgezési tünetekért. [1] |
Endokrin rendszert károsító | - |
Immunrendszert károsító | - |
Szövetkárosító | - |
Mutagén | Mutagén hatás nem lett kimutatva. [6] |
Karcinogén | Karcinogén hatás nem lett kimutatva. [6] |
Reprotoxikus, teratogén | Terhességi kockázati csoport: C [10] |
Akut toxicitási adatok (LD50) | LD50 orális: 2460 mg/kg [4] |
Krónikus toxicitási adatok (NOEL, LOEL) | - [6], [9] |
EGYÉB JELLEMZŐK | |
| - |
- nincs adat
Forrás:
[kép] http://upload.wikimedia.org/wikipedia/commons/7/76/Acetonitrile-2D.png
[1] Wikipédia hivatalos honlapja: http://hu.wikipedia.org/wiki/Acetonitril
[2] Merck Chemicals Hungary hivatalos honlapja: http://www.merck-chemicals.hu/safety-data-sheets/c_O_Sb.s1LQz0AAAEWVOYfVhTo
[3] Wapedia német nyelvű honlap: http://wapedia.mobi/de/Acetonitril
[4] Wikipédia angol nyelvű honlap: http://en.wikipedia.org/wiki/Acetonitrile#Toxicity
[5] Európai Bizottság (Joint Research Centre) angol honlap: http://ecb.jrc.it/DOCUMENTS/Existing-Chemicals/RISK_ASSESSMENT/SUMMARY/acetonitrilesum006.pdf
[6] Prof.Dr. Rainer Winter honlapja: http://www.agwinter.chemie.uni-konstanz.de/data/SS10/Sicherheitsdatenblaetter/Acetonitril.pdf
[7] Wikipédia hivatalos honlapja: http://hu.wikipedia.org/wiki/Nitrilek#Hidrol.C3.ADzis
[8] Novasol angol nyelvű honlap: http://www.novasol.be/acetonitrile.asp?gclid=CKPK6eCppaQCFYyGzAod2wz74A
[9] GMS Chemie német nyelvű honlap: http://www.gms-chemie.de/merge_pdf.php
[10] Országos Munkahigiénés és Foglalkozás-egészségügyi Intézet honlapja: http://www.omfi.hu/icsc/PDF/PDF00/icsc0088_HUN.PDF
[11] INEOS Nitriles angol nyelvű honlap: http://www.ineosnitriles.com/media/files/ACETONITRILE%2098%20.pdf
[12] BME Kémiai és Környezeti Folyamatmérnöki Tanszék honlapja: http://kbkf.kkft.bme.hu/oldoszerek.pdf