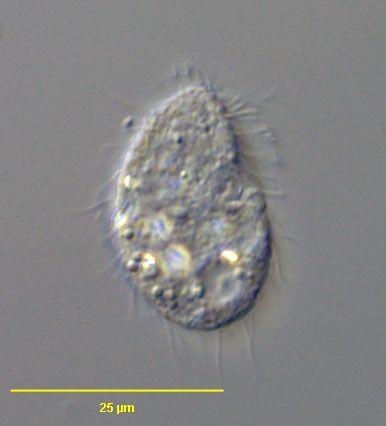
Tesztorganizmus neve | |
Latin név | Colpoda steinii |
Rendszertani besorolás [1] | |
Ország | Protozoa |
Törzs | Ciliophora |
Osztály | Ciliatea |
Rend | Entodiniomorphida |
Család | Colpodidae |
Nem | Colpoda |
Faj | Colpoda steinii |
Tesztorganizmus jellemzői | |
Élőhely | talaj [2] |
Fontosabb külső jegyek | Átlagos mérete: 20-40 x 15-30 mikron. [3] Csillós, és mivel protozoa, ezért nem rendelkezik sejtfallal. [2] |
Táplálkozás | Vizes közegben táplálkoznak így a vizes közegű tesztoldatokban lévő toxikus anyag a táplálékkel együtt kerül be a sejtjébe. [2] |
Szaporodás | Rendszerint osztódással szaporodik. A cisztából kb. 4-8 egyed fejlődik ki. [4] |
Egyéb fontosabb jellemzők | Széles körben elterjedt kis- és közepes méretű faj, általában szabadon élő, de szárazföldi csigák parazitáiként is megfigyelhető. [5] |
Szabványok és referenciák [2] | |
Szabványosított tesztmódszer? | nem |
Nem szabványos tesztmódszerek | Colpoda steinii növekedésgátlási vizsgálata (talajra adaptált és direkt kontaktra kidolgozott változat: BME-MGKT) |
Környezettoxikológiai alkalmazás | |
Tesztorganizmus fenntartása | A Colpoda steinii szaporítása egy növekedésben lévő Pseudomonas fluorescens baktériumtenyészeten történik. A Pseudomonas fluorescens tenyészetet 25 °C-on 48 órán át szaporítjuk "E" tápoldatban (a). A Colpoda steinii szaporítása az (a) tápoldatban történik, 25 °C-on 48 órán át (b). "E" tápoldat:
Mikroelem oldat:
[2] |
Teszteléshez használt organizmus jellemzői | A Pseudomonas fluorescens-t 1:10 hígítású NB tápoldatban 25 °C-on 24 órán át levegőztetve szaporítjuk (c). A Colpoda steinii-t 25 °C-on 24 órán át tenyésztjük (c)-ben, levegőztetés mellett (d). Párhuzamosan a Pseudomonas fluorescens-t 50 ml NB-ben 25 °C-on 24 órán át szaporítjuk (e). NB tápoldat (Nutrient Broth):
[2] |
Tesztorganizmus érzékenysége | nehézfémek [6] |
Tesztmódszer alkalmassága | pórusvíz, talajkivonat, talaj szuszpenzió [2], talaj [6] |
Tesztelés elve | Akut toxicitási teszt. A tesztorganizmusunk szaporodását befolyásolja a mintánk tartalma, és ebből következtethetünk a minta toxikus hatásaira. |
Tesztmódszer leírása | A vizsgálat menete: Az (e) tenyészet sejtjeit centrifugáljuk 3600 rpm-en 10 percig, 50 ml-es centrifugacsöveket használva. A sejteket kétszer mossuk P+J oldattal és 10 ml-el szuszpendáljuk fel. A P+J oldat tejszerűvé teszi a sejtszuszpenziót (f). P+J oldat:
A teszteléshez használandó Colpoda sejtek denzitásának ellenőzése a (d) szuszpenzióban történik. A (d)-ből kivett, ismert mennyiségű sejtszuszpenziót Lugol-oldattal rögzítjük (1 csepp ml-enként), megfestjük malachitzölddel (1 csepp ml-enként) és végül mikroszkóp alatt Bürker kamrában megszámláljuk a Colpoda sejteket. Malachitzöld oldat:
A mérés kivitelezése: A tesztcsövekbe mérünk:
Inkubálás: a kémcsöveket 25 °C-on 24 órán át tartjuk az inkubátorszobában vagy termosztátban. Ahhoz, hogy elkerüljük a minták benedvesedését vagy befertőződését steril, fedhető kémcsöveket alkalmazunk. Rögzítés és számlálás, a mérés kiértékelése: 24 óra után 1 csepp Lugol oldatot és 1 csepp malachitzöld oldatot adunk minden egyes mintához. A mintákat Bürker kamrában számláljuk. A pipettázás előtt a mintákat jól felrázzuk, a számlálókamrát pedig fedőlemezzel fedjük le és mikroszkóp alatt számláljuk a sejteket. A Colpoda steinii a toxikus anyag hatására inaktívvá válhat és sejtcsoportosulást hozhat létre. Ez megnehezíti a mikroszkóp alatt történő számlálást. Számlálás részecskeszámlálóval: A sejtek számának megállapítására elektronikus sejtszámlálót is lehet alkalmazni. LABORSCALE (PSL-1) - ANALISATOR (PSA-1) részecskeszám- és részecskenagyság elemző készülékkel (Medicor Művek) végezhetjük a mérést. A Colpoda steinii inaktív formában hajlamos összecsapódni, a sejtcsoportosulás megszüntetésére ultrahangos dezintegrátoros kezelést alkalmazunk 10 másodpercig. A sejtszámláláshoz használt mérőkapilláris: 200 mm. A mérőáram 400 mA. Minimum három párhuzamos mérést kell végezni. Akkor kezdhetjük a mérést, amikor a háttér 0 értéket mutat. |
Mérési végpontok | élő tesztorganizmusok száma [2] |
Méréshez szükséges műszerek | mikroszkóp vagy elektromos részecskeszámláló [2] |
Tesztek időigénye | 48 óra [2] |
Egyéb | |
Megjegyzések | Az állati egysejtűekkel való munka viszonylag egyszerű és gyors, az eredmény a környezeti kockázatfelmérésben igen fontos trofikus szintet (állat) képvisel. [2] |
[1]: Integrated Taxonomic Information System; Colpoda steinii Maupas, 1883; Taxonomic Hierarchy: http://www.itis.gov/servlet/SingleRpt/SingleRpt?search_topic=TSN&search_value=193495 (2012. szeptember 20.)
[2]: Gruiz K., Horváth B., Molnár M. (2001): Környezettoxikológia, Vegyi anyagok hatása az ökoszisztémára. Műegyetemi Kiadó, Budapest
[3]: Encyclopedia of Life; Description of Colpoda steinii: http://eol.org/pages/596166/details (2012. szeptember 20.)
[4]: Colpoda videos: http://www.3dham.com/colpoda_videos/index.html (2012. szeptember 20.)
[5]: Reynolds Bruce D. (Febr., 1936): Colpoda steini, a Facultative Parasite of the Land Slug, Agriolimax agrestis. The Journal of Parasitology Vol. 22, No. 1, pp. 48-53.
[6]: Colin D. Campbell, Alan Warren, Clare M. Cameron, Susan J. Hope: Direct toxicity assessment of two soils amended with sewage sludge contaminated with heavy metals using a protozoan (Colpoda steinii) bioassay. Abstract: http://www.researchgate.net/researcher/82593404_Colin_D_Campbell (2012. szeptember 20.)