Tesztorganizmus neve | |
Latin név | Tetrahymena pyriformis |
Magyar név | Tetrahymena pyriformis |
Angol név | Tetrahymena pyriformis |
Rendszertani besorolás | |
- ország | Protozoa [5] |
- törzs | Ciliophora [5] |
- osztály | Oligohymenophorea [5] |
- rend | Hymenostomatida [5] |
- család | Tetrahymenidae [5] |
- nemzetség/nem |
|
- faj | Tetrahymena pyriformis |
Tesztorganizmus jellemzői | |
Élőhely | víz |
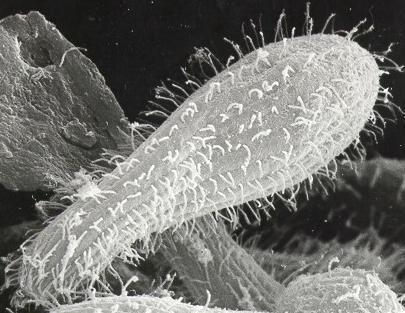
Fontosabb külső jegyek | 25–90 μm hosszú, körte alak, sejtszáj négy mozgó hártyaszerű képlet, sűrű hajszerű bevonatot alkotnak a csillók [2] |
Táplálkozás | kisebb élőlények [5] |
Szaporodás | csillósok ált. ivartalanul szaporodnak, 3-4 óra alatt megkétszereződnek (ideális körülmények között) [5] |
Egyéb fontosabb jellemzők | Kedvelik mert rövid a periódus ideje és ennek a fajnak a reagálása hasonlít legjobban a nagyobb rendű állatok sejtjeinek reagáláshoz. Kommenzalizmus, mint populációs kölcsönhatás jellemző rá. [1], [6] |
Szabványok és referenciák | |
Szabványosított tesztmódszer? | nem [1] |
Szabvány típusa, száma |
|
Nem szabványos tesztmódszerek |
|
Környezettoxikológiai alkalmazás | |
Tesztorganizmus fenntartása | vizes élőhely, 28 °C-on sötét helyen, PP tápoldatban [2], [1] |
Teszteléshez használt organizmus jellemzői | fenntartás és inkubálás is 28 °C-on sötét helyen, kora ne legyen több 6 hetesnél, pH kb. 7,35; ne legyen rázatás se szellőztetés [2] |
Tesztorganizmus érzékenysége | vízben oldható szennyezőanyagok [2], n-oktanol, 2,4-DCP; 2,4-DNP; ciklohexán, 2-metilfenol; 3-metilfenol; 4-metilfenol; 3,4-dimetilfenol; 3-hidroxidpiridin, 2-klorid-3,5-dinitropiridin[1], [6] |
Tesztmódszer alkalmassága | víz, talaj |
Tesztelés elve | sejtszám változás, szaporodás gátlás [1] |
Tesztmódszer leírása | Sejtszuszpenzió elkészítése (50 cm3 PP-tápoldat + 2 cm3 sejtszuszepnzió). 16 óra múlva ebből kémcsőbe helyezünk 5 cm3-t. Ezt hígítjuk majd felöntjük a vizsgálandó oldattal. 48 óra inkubálás következik. A kémcsövek felső rétegéből mintát veszünk amit 1 %-os formaldehiddal rögzítünk. Ebben az oldatban számláljuk a tesztorganizmust Bürker-kamrában. Kontrollhoz viszonyítunk. [2],[3],[4] |
Mérési végpontok | élő tesztorganizmusok száma |
Vizsgálati végpontok | Leginkább LC50-t vagy EC50-t vizsgálnak. Az alábbi példák az [1] tanulmányból származnak. n-oktanol: LC50=13,5 mg/L [1] 2,4-DCP: LC50=9,19 mg/L [1] 2,4-DNP: LC50=14,4 mg/L [1]
|
Méréshez szükséges műszerek | Bürker kamra, Laborscale (PSL-1)-analisator (PSA-1) |
Tesztek időigénye | 48-66 óra, talajnál 72 óra, [1], [2] |
Egyéb | |
Megjegyzések |
|
{1} JϕRGEN LARSEN, T.W. SCHULTZ, LEIF RASMUSSEN, RIA HOOFTMAN, WILFRIE PAULI (1997): PROGRESS IN AN ECOTOXICOLOGICAL STANDARD PROTOCOL WITH PROTOZOA: RESULTS FROM A PILOT RINGTEST WITH Tetrahymena pyriformis. Chemosphere, Vol. 35, No. 5, pp. 1023-1041. 1997
{2} Gruiz K., Horváth B., Molnár M. (2001) Környezettoxikológia, Vegyi anyagok hatása a környezetre. Műegyetemi Kiadó, Budapest
{3} /keptar/5293
{4} /keptar/5270
{5} http://en.wikipedia.org/wiki/Tetrahymena
{6} Julie R. Seward a, Elizabeth L. Hamblen, T. Wayne Schultz:Regression comparisons of Tetrahymena pyriformis and Poecilia reticulata toxicity. Chemosphere, Vol. 47, pp. 93–101. 2000