Tesztorganizmus neve | |
Latin név | Scenedesmus subspicatus |
Magyar név |
|
Angol név |
|
Rendszertani besorolás | |
- ország | Plantae (Növények)[1] |
- törzs | Viridaeplantae (Zöld növények)[1] |
- osztály | Chlorophyceae (Zöldmoszatok)[1] |
- rend | Sphaeropleales[1] |
- család | Scenedesmaceae[1] |
- nemzetség/nem | Scenedesmus (Desmodesmus)[1] |
- faj | Scenedesmus subspicatus (Desmodesmus subspicatus)[1] |
Tesztorganizmus jellemzői | |
Élőhely | édesvíz, felszínhez közel [8] |
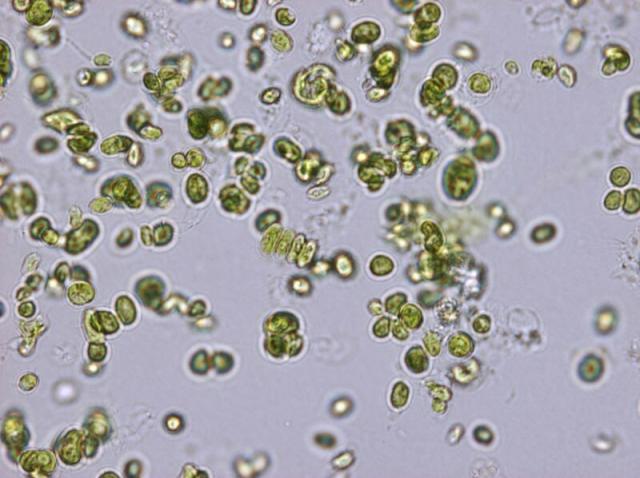
Fontosabb külső jegyek | az alga enyhén zöldes színű (klorofiltartalma miatt); kis nyúlványaik vannak, ovális alakú; általában 3-4 egy csoporttá alakul (ekkor alakjuk hosszúkássá válik); ha hármas csoportokká alakulnak és megtartják ovális alakjukat az fertőzés jelenlétére utal; az összes alga körülbelül azonos méretű [6] |
Táplálkozás | Fotoszintézis [8] |
Szaporodás | Ivartalan [8] |
Egyéb fontosabb jellemzők | lemezes teleptestűek, a sejtfal cellulózból épül fel [8] |
Szabványok és referenciák | |
Szabványosított tesztmódszer? | igen |
Szabvány típusa, száma | DIN 38412/33 talajkivonatok tesztelésére [3] ISO 8692:1989 vízminőségi teszt [2] MSZ EN 28692:1998 (visszavonva) [4] OECD 201 [5] |
Nem szabványos tesztmódszerek |
|
Környezettoxikológiai alkalmazás | |
Tesztorganizmus fenntartása | tápagaron, tápsóoldatban [6] Az alga növekedéséhez 10:14 órás sötét:világos ciklus és 20-25°C szükséges.[6] |
Teszteléshez használt organizmus jellemzői | Megfelelő koncentrációjú algaszuszpenzióra van szükség.[6] Az algáknak az exponenciális növekedési fázisban kell lenniük a teszt megkezdésekor. |
Tesztorganizmus érzékenysége | vízoldható vegyi anyagokhoz, vízi rendszerek ökotoxikológiai vizsgálatához [6] |
Tesztmódszer alkalmassága | A felszíni vizek, talajvizek, szennyvizek toxikológiai vizsgálatához [6], talaj esetén talajkivonatok vizsgálatára alkalmas [7]. |
Tesztelés elve | Az alga növekedési teszt a toxikus vegyi anyagoknak az elsődleges termelők anyagcsere-folyamataira gyakorolt gátló hatását vizsgálja.[7] |
Tesztmódszer leírása | MSZ EN 28692:1998 teszt: Minden folyamathoz steril fülkét kell használni. A teszt indításához megfelelő koncentrációjú algaszuszpenzió szükséges. Ehhez friss alga tápoldattal le kell mosni az algasejteket az agar felszínéről, majd Bürker-kamra segítségével lehet meghatározni az algakoncentrációt. A teszthez az algaszuszpenzió kiindulási sejtszáma 2-6×105 db sejt/ml legyen. A mérés tesztedényei mikrolemezek. Minden cellába be kell mérni 100µl-t a korábban elkészített és megfelelő sejtszámú algaszuszpenzióból, majd a bemért algára rá kell mérni 100µl-t a tesztelni kívánt mintából is. A teszt indításakor, majd 24 óránként kell mérni optikai denzitás (OD) mérés esetén a mikrolemezek celláiban található algaszuszpenzió optikai denzitását, melyet egy spektrofotométerrel, 4 különböző hullámhosszon (405, 450,490, 630 nm-en) kell meghatározni. A méréseket KC Junior szoftver segítségével lehet kiértékelni, melyben az idő-OD értékek alapján meghatározható a szaporodási görbe alatti terület. Ebből a szaporodásgátlási százalék határozható meg, mely által a 20%-os és az 50%-os gátláshoz tartozó koncentrációkat az EC20 és EC50 adatokkal adhatjuk meg. [4] |
Mérési végpontok | sejttömeg, a sejtszám, a szaporodási görbe alatti terület, klorofill tartalom [3], optikai denzitás, extinkció [6] |
Vizsgálati végpontok | akut végpontok: EC10 EC20, EC50, LC20, LC50 [5][6] krónikus végpontok: NOEC, PNEC [5] Pentán: EC50 =1,1 mg/l – 72 óra [9] Izoproturon: LC50= 0,012 mg/l – 72 óra [9] Trietanolamin: EC50= 216 mg / l – 72 óra [9] EC50 = 169 mg / l – 96 óra [9] NOEC = 100 mg/L – 100 óra [9] Linuron: EC50 = 0,016 mg/l – 72 óra [9] Etil-acetát : EC50 =3300 mg/l – 48 óra [9] NOEC > 100 mg/l – 72 óra [9] Trisz(nonilfenil)-foszfit NOEC = 100 mg/l 100 óra [9]
|
Méréshez szükséges műszerek | mikroszkóp vagy fotométer [6] |
Tesztek időigénye | akut: 24-96 h, krónikus: 21, 28 nap [5] |
Egyéb | |
Megjegyzések |
|
[1] Integrated Taxonomic Information System (ITIS) www.itis.gov
[2] The International Organization for Standardization (ISO) www.iso.org
[3] MOKKA lexikon www.enfo.hu/mokka
[4] Édesvízi alga növekedésgátlási tesztje egysejtű zöldalgafajokkal MSZ EN 28692:1998 www.mszt.hu
[5] OECD 201 Alga teszt, Növekedés gátlási teszt OECD 201 http://www.oecd.org
[6] Budapesti Mőszaki és Gazdaságtudományi Egyetem Alkalmazott Biotechnológia és Élelmiszertudományi Tanszék (2010): Ökotoxikológiai módszerek vízi tesztorganizmusokkal
/sites/default/files/vizi%20tesztorganizmusok_0.pdf
[7] Gruiz Katalin, Horváth Beáta, Molnár Mónika (2001): Környezettoxikológia, Vegyi anyagok hatása a környezetre, Műegyetem Kiadó, Budapest
[8] Dr. Bartha Dénes (2009): Növényrendszertan előadás http://www.emk.nyme.hu/fileadmin/dokumentumok/emk/novenytan/novenytan/rt/eloadas/nrt_03.pdf
[9] BME ABÉT Környezeti Mikrobiológia és Biotechnológia Csoport Körinfó honlapja http://enfo.hu/node/36