Tesztorganizmus neve | |
Latin név | Pseudomonas fluorescens |
Magyar név |
|
Angol név |
|
Rendszertani besorolás | |
- ország | Bacteria (Baktérium) [1] |
- törzs | Proteobacteria (Proteobatérium) [1] |
- osztály | Gammaproteobacteria (Gamma-proteobaktérium) [1] |
- rend | Pseudomonadales [1] |
- család | Pseudomonadaceae [1] |
- nemzetség/nem | Pseudomonas [1] |
- faj | Pseudomonas fluorescens |
Tesztorganizmus jellemzői | |
Élőhely | Rizoszféra (talaj felső rétege, mely érintkezik növények gyökérzetével), filoszféra (növények talaj feletti felülete), víz, ideális hőmérséklet 25 – 30 °C. [2] |
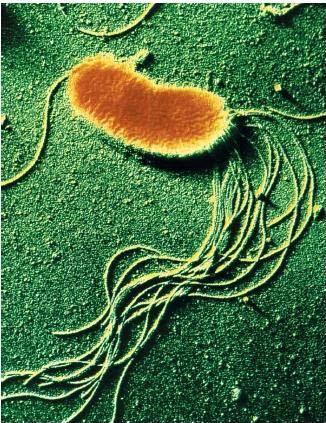
Fontosabb külső jegyek | Pálcika alakú, több ostora (flagella) van, melyekkel önálló mozgást végez. Pioverdint nevű zöld színű fluoreszcens pigmentet termel. [3] |
Táplálkozás | Obligát aerob. Heterotróf, változatosan és intenzíven táplálkozik. [1] |
Szaporodás | Osztódással. [4] |
Egyéb fontosabb jellemzők | Gram negatív baktérum. Biofilmet képez, mely védelmi funkcióval bír. [3] |
Szabványok és referenciák | |
Szabványosított tesztmódszer? | Nem |
Szabvány típusa, száma | − |
Nem szabványos tesztmódszerek | Mono-, di- és tri-klorofenolok toxicitásának mérése vizes oldatban lux génnel jelölt Pseudomonas fluorescens alkalmazásával [6] Kadmium hatása vizes közegben Pseudomonas fluorescens fajra [9] Ittrium biokkumulációja Pseudomonas fluorescens-ben [10] |
Környezettoxikológiai alkalmazás | |
Tesztorganizmus fenntartása | Tárolás fagyasztott állapotban -80 °C-on. [5] |
Teszteléshez használt organizmus jellemzői | Pseudomonas fluorescens, Spanish Type Culture Collection (CECT no 385, ATCC no 13525). [5] |
Tesztorganizmus érzékenysége | Csak nehézfémet tartalmazó víz esetén: 1.2 mg/l < EC20 < 65.3 és 6.6 mg/l < EC50 < 188 mg/l (legérzékenyebb higanyra, legkevésbé érzékeny nikkelre a vizsgált hat nehézfém közül). |
Tesztmódszer alkalmassága | Nehézfémek toxicitásának mérése oldatban: Cr6+, Cd2+, Cu2+, Hh2+, Ni2+, Zn2+. [5] |
Tesztelés elve | A nehézfém szennyezők toxikusak a Pseudomonas fluorescens fajra nézve. A biológiai aktivitás csökkenése magával hordozza a légzés intenzitásának csökkenését. A elektrontranszport láncban mesterséges végső elektronakceptorként az INT nevű tetrazólium-sót használjuk, mely a redukció eredményeképp oldhatatlan formazánná válik. Ez a vegyület forometriásan mérhető, a szennyezett mintáknak a fényelnyelését viszonyítjuk a kontrolléhoz az INT-formazán színének hullámhosszán. [5] |
Tesztmódszer leírása | A vizsgált nehézfémeket sók (Cr6+ (K2CrO4), Cu2+ (CuCl2·H2O), Cd2+ (CdCl2), Hg2+ (HgCl2), Ni2+ (NiCl2), Zn2+ (ZnCl2)) formájában adták egyrészt ionmentes vízhez (nehézfém-oldatok), másrészt szennyvízhez. |
Mérési végpontok | Fényelnyelés, azaz optikai abszorbancia 460 nm hullámhossznál. [5] |
Vizsgálati végpontok | Kontroll mintához viszonyított abszorbancia, melyből EC20 és EC50 értékek számíthatók. [5] |
Méréshez szükséges műszerek | Vortex, centrifuga, inkubátor, spektrofotométer |
Tesztek időigénye | Akut, 3-4 óra |
Egyéb | |
Megjegyzések | Mezőgazdaságban növényvédelemre használják, mivel távol tartja a növényi patogén organizmusokat. |
[1] Wikipedia, Pseudomonas fluorescens
http://en.wikipedia.org/wiki/Pseudomonas_fluorescens
letöltés ideje: 2012.11.12.
[2] Morgan Boresi: Pseudomonas fluorescens
http://web.mst.edu/~microbio/BIO221_2009/P_fluorescens.html
letöltés ideje: 2012.11.15.
[3] Buzzle - Ningthoujam Sandhyarani: Pseudomonas fluorescens
http://www.buzzle.com/articles/pseudomonas-fluorescens.html
letöltés ideje: 2012.11.15.
[4] Google sites, Pseudomonas fluorescens
https://sites.google.com/site/sassiteforscience/standard-2/objective-d
letöltés ideje: 2012.11.15.
[5] A. Pérez-García, J. C. Codina, F. M. Cazorla, A. de Vicente (1993) Rapid respirometric toxicity test: Sensitivity to metals
Bulletin of Environmental Contamination and Toxicology, May 1993, Volume 50, Issue 5, pp 703-708
http://link.springer.com/article/10.1007/BF00194665
[6] Elaine M Boyda, Ken Killhamb, Andrew A Meharg (2001) Toxicity of mono-, di- and tri-chlorophenols to lux marked terrestrial bacteria, Burkholderia species Rasc c2 and Pseudomonas fluorescens
Chemosphere, Volume 43, Issue 2, April 2001, Pages 157–166
http://www.sciencedirect.com/science/article/pii/S0045653500002666
[7] Tiina Petänena, Martin Romantschuka (2003) Toxicity and bioavailability to bacteria of particle-associated arsenite and mercury
Chemosphere, Volume 50, Issue 3, January 2003, Pages 409–413
http://www.sciencedirect.com/science/article/pii/S0045653502005052
[8] Elaine M. Boyd, Kenneth Killham, Julian Wright, Stephen Rumford, Malcolm Hetheridge, Rob Cumming, Andrew A. Meharg (1997) Toxicity assessment of xenobiotic contaminated groundwater using lux modified Pseudomonas fluorescens
Chemosphere, Volume 35, Issue 9, November 1997, Pages 1967–1985
www.sciencedirect.com/science/article/pii/S0045653597002713
[9] ASTM International, Seyfried PL, Horgan CBL (1985) Comparison of Techniques for Evaluating the Effect of Cadmium on Pseudomas Fluorescens
http://www.astm.org/DIGITAL_LIBRARY/STP/PAGES/STP33582S.htm
[10] Vasu D. Appanna, John Huang (1992) Bioaccumulation of Yttrium in Pseudomonas fluorescens
Bulletin of Environmental Contamination and Toxicology, October 1992, Volume 49, Issue 4, pp 620-625
http://link.springer.com/article/10.1007/BF00196308
[11] MicrobeWiki, Pseudomonas fluorescens
http://microbewiki.kenyon.edu/index.php/Pseudomonas_fluorescens
letöltés ideje: 2012.11.15.
[12] theLabRat, Pseudomonas fluorescens
http://www.thelabrat.com/restriction/sources/Pseudomonasfluorescens.shtml
letöltés ideje: 2012.11.15.