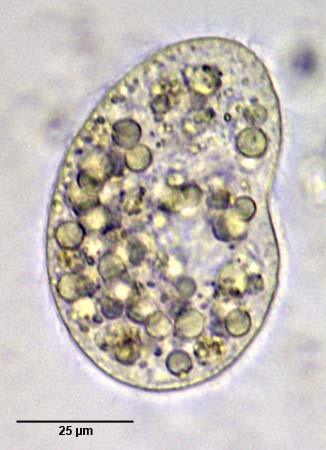
Tesztorganizmus neve | |
Latin név | Colpoda cucullus |
Magyar név | szénainfuzórium [1] |
Angol név |
|
Rendszertani besorolás | |
- ország | Protozoa |
- törzs | Ciliophora |
- osztály | Ciliate |
- rend | Entodiniomorphida |
- család | Colpodidae |
- nemzetség/nem | Colpoda |
- faj | Colpoda cucullus |
Tesztorganizmus jellemzői | |
Élőhely | talaj [2]; növények felülete [3]; édesvizek, pocsolyák [4] |
Fontosabb külső jegyek | Mérete: 40-120 mikron (általában 60-80 x 40-60 mikron) [5] A testi csillóik dikinetidákból állnak, mely mindkét tagjáról erednek csillók. [6]
|
Táplálkozás | Elsősorban baktériumokkal, de zooflagellátákat és algákat is fogyaszt alkalmanként. [5] |
Szaporodás | Általában ivartalan módon, osztódással szaporodik, mely során rendszerint 4 egyed fejlődik ki. Esetenként ivaros konjugáció is bekövetkezik (ennek során két egyed összekapcsolódik, majd a folyamat végeztével szétválnak, az egyedszám nem változik) [6] |
Egyéb fontosabb jellemzők | Mozgás: 310-370 mikrométer/s [5] |
Szabványok és referenciák | |
Szabványosított tesztmódszer? | nincs |
Szabvány típusa, száma |
|
Nem szabványos tesztmódszerek |
|
Környezettoxikológiai alkalmazás | |
Tesztorganizmus fenntartása | 0,1% (w/w) baktériummal (Enterobacter aerogenes) 24 órával előre beoltott, szárított gabonalevél kivonaton, 25°C-on, sötétben [7] [8] |
Teszteléshez használt organizmus jellemzői | steril kultúra [9] |
Tesztorganizmus érzékenysége | herbicidek [10], nehézfémek [11] |
Tesztmódszer alkalmassága | talaj, talajkivonat, talajszuszpenzió, felszíni és felszín alatti valamint pórus- és csurgalékvíz |
Tesztelés elve | Akut toxicitási teszt, 9 órás illetve 12 és 24 órás |
Tesztmódszer leírása | Kémcsövekben inokulum készítés: -PAS (Page’s modified Neff’s amoebea saline): 120 mg NaCl, 4mg MgSO4 * 7 H2O, 4 mg CaCl2 *2H2O, 142 mg NaHPO4 és 136 mg KH2PO4 / 1 liter desztillált víz -Entherobacter aerogenes -15 ml C. cucullus szuszpenzió [9] Másik leírás: 30 egyedet izolálják és helyezik a tesztelendő anyag 2 ml-nyi oldatába. Az életben marad sejteket 12 és 24 óra kontaktidő után számolják mikroszkóppal 100x-os nagyítással. Három párhuzamossal és negatív kontrollal kivitelezik. [12]
Subletális teszt: Lugol-oldattal történő fixálás után a mintákból háromszor 0,1 ml-t vesznek és a sejtek számát illetve méretét (hossz és szélesség) mikroszkóp segítségével mérik. [12]
|
Mérési végpontok | élő sejtszám, sejt mérete, szaporodási |
Vizsgálati végpontok | mortalitási arány, szaporodási ráta, duplázódási idő, sejtméret csökkenés; LC20, LD20, LC50, LD50 |
Vizsgálati végpont: irodalmi példák és adatok | diterpenoidra [12]: |
Méréshez szükséges műszerek | fénymikroszkóp min 100x-os nagyítással |
Tesztek időigénye | 1-9 óra [10] ill. 24 óra [12] |
Egyéb | |
Megjegyzések | A Colpoda cucullus az egyik legelterjedtebb talajlakó protozoa. A protozoákkal igen jelentős trófikus szintet képviselnek. A velük végzet tesztek általában könnyen kivitelezhetőek, a tenyészet egyszerűen fenntartható. Jellemzően nagyon érzékeny tesztorganizmusok [13] |
[1] Magyar Elektronikus Könyvtár; Alfred Eduard Brehm: Az állatok világa; http://mek.oszk.hu/03400/03408/html/3155.html
[2] Methodology for Quantitative Determination of Polycyclic Armatic Hydrocarbons in Protozoa Cultures
[3] Oxford Journal honlapja: http://icb.oxfordjournals.org/content/13/1/171.abstract
[4] Kolozsvári Babes-Bolyai Tudományegyetem Gerinctelen állattan tantárgy lapja: http://gerinctelenallattan.files.wordpress.com/2010/10/002_egysejtuek2.pdf
[5] Encyclopedia of Life http://eol.org/pages/490939/details
[6] Török Júlia Katalin, Bevezetés a protisztológiába, 2012 ELTE TTK Biológiai Intézet
[7] Ryoji Funatani, Akemi Kida, Tomoko Watoh, Tatsuomi Matsuoka; Morphological events during resting cyst formation int he ciliate Colpoda cucullus, Protistology 6 (3) 204-217; 2010
[8] ATCC honlapja
http://www.lgcstandards-atcc.org/products/all/30916.aspx?geo_country=hu#culturemethod
[9] National Institute for Environmental Studies, Japan honlapja
http://www.nies.go.jp/chiiki1/protoz/toxicity/protozoa/colpoda.htm illetve B.Schreiber, N. Brink; Pesticide toxicity using protozoans as test organisms, Biology and Fertility of Soils, (1989) 7:289-296
[10] Castor-Ortíz Lourdes Patricia, Luna-Pabello Víctor Manuel, Garcia-Calderón Norma, Rodrígez-Zaragoza Salvador, Flores-Hernandez Jorge, Ávila Licona Arturo: Toxicological effect of DDT in Colpoda cucullus and its potential application informing environmental biosensor; Journal of Microbiology Vol. 3(4) pp. 117-126, April 2012
[11] M.P.M. Janssen, C.Oosterhoff, G.J.S.M. Heijmans, h. Van der Voet; The toxicity of Metal Salts and the Population Growth od the Ciliate Colpoda cucullus
[12] Ning Ying Zhi, Cu Hai Feng, Zou Tao, Wang Hong Jun, Wang Xiao Jing, Liu Han Cheng, Ma Zheng Xue, Ding Lan; Allelopathy of diterpenoids on three species of soil ciliates; Acta Ecologica Sinica 31; 317-321; 2011
[13] Gruiz Katalin, Horváth Beáta, Molnár Mónika; Környezettoxikológia, Műegyetemi Kiadó, 2001