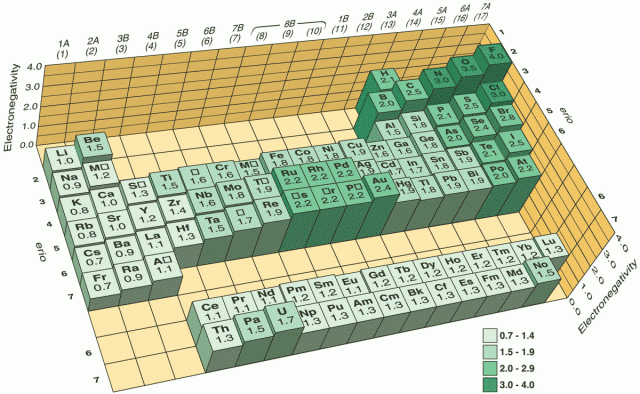
Az elektronnegativitás a kötött állapotú atom elektronvonzó képességére utaló viszonyszám. A viszonyítási rendszert Linus Pauling amerikai vegyész dolgozta ki. A meghatározott elektronnegativitás legnagyobb értéke a fluorhoz tartozik, értéke 4, a legkisebb a franciumé (0,7). A nemesgázoknál nem értelmezték az elektronnegativitást, mert ezeket sokáig nem sikerült kémiai reakcióba vinni, és így nem rendelkeztek megfelelő energetikai adatokkal.
Az elektronnegativitás a rendszámmal periódikusan változik: a periódusokban nő, a főcsoportokban pedig csökken. A periódusokban való növekedést a magtöltés növekedése miatt kialakuló egyre nagyobb magvonzással magyarázhatjuk, a főcsoportokban viszont a vegyértékhéj egyre távolabb kerül az atommagtól, így a mag vonzó hatása is egyre kisebb lesz a vegyértékhéjra, illetve az atomtörzs szélére.
Jele: EN
Villányi Attila - Kémia