Vegyjel: C
Rendszám | 6 |
Atomtömeg | 12.011 g/mol |
Elektronegativitás | 2.5 |
Sűrűség (20°C-on) | 2.2 g/cm3 |
Olvadáspont | 3652 °C |
Forráspont | 4827 °C |
Atomsugár | 0.091 nm |
Ionsugár | 0.26 nm (-4) ; 0.015 nm (+4) |
Izotópok | 3 |
Elektronszerkezet | [ He ] 2s22p2 |
Első ionizációs energia | 1086.1 kJ/mol |
Második ionizációs energia | 1086.1 kJ/mol |
Harmadik ionizációs energia | 1086.1 kJ/mol |
Felfedezte | Ókori klasszikus elem |
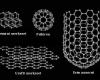
A szén kiemelkedő jelentőségű kémiai elem, tulajdonságai egyedülállóak, mivel önmagában és vegyületeiben is jobb kémiai tulajdonságokkal bír, mint az összes többi elem kombinációja. A legnagyobb csoportot a hidrogénnel alkotott vegyületei képezik. Legalább egy millió szerves anyagot ismerünk, de ezek száma évről évre növekszik. Léteznek szén-formák, melyek a szervetlen vegyületek közé tartoznak, de ezek száma csekély a szerves csoporthoz képest. Az elemi szénnek több allotróp kristályos módosulata létezik: a gyémánt, a grafit és a fullerének. Egyéb formái a növényi szén és a szerves anyagok égése során képződő fekete füst.
A szén módosulatok sűrűsége változó a grafité 2,25 g/cm ³, a gyémánté pedig 3,51 g/cm ³. A grafit olvadáspontja 3500ºC és a forráspontja 4830°C. Az elemi szén egy inert anyag, vízben, higított savakban és lúgokban, valamint a szerves oldószerekben nem oldódik. Magas hőmérsékleten oxigénnel szén-monoxidot vagy –dioxidot alkot. Forró oxidálószerekben, mint például a salétromsav és a kálium-nitrát feloldható. A halogének közül csak fluorral reagál. Továbbá fémekkel magas hőmérsékleten karbidot képez.
Három gáz halmazállapotú vegyületet képez oxigénnel: szén-monoxid (CO), szén-dioxid (CO2) és szén-szuboxid (C3O2). Halogénekkel képzett vegyületeinek az általános képlete CX4, ahol az X: fluor, klór, bróm és jód is lehet. Szobahőmérsékleten a szén-tetrafluorid gáz, a -tetraklorid folyékony és a másik két vegyület szilárd halmazállapotú. A legjelentősebb a difluor-diklór-metán (CCl2F2) vagy más néven freon.
Alkalmazások:
A gyémántból ékszereket, illetve vágó- és csiszolóeszközöket készítenek, amelyek nagyon értékesek. A grafitot nagy szilárdságú, korrózióálló tégelyek, kádak, zárócsatlakozók készítéséhez használják fel. A természetes szenek energiahordozók (faszén, kőolaj, földgáz) és vegyipari alapanyagok. A szén vegyületeit szinte minden területen felhasználjuk. Egyre növekvő mennyiségben alkalmazzák különféle műanyagok előállítására, amelyek mind szerves polimerek.
Szénvegyületeket is nagyszámban használnak. A szén-dioxidot szénsavas üdítőitalok előállítására, tűzoltó készülékekben, és szilárd formában szárazjégnek. A szén-monoxidot redukálószerként kohászati folyamatokban. A szén-tetraklorid és a szén-diszulfid fontos ipari oldószerek. A freon hűtési rendszerekben. A kalcium-karbid felhasználható acetilén előállítására, hegesztéseknél, valamint más szerves vegyületek előállítására. Egyéb fém-karbidokat is alkalmaznak iparban, például fémek vágásánál.
![[node-title]](/sites/default/files/styles/keptar_fokep/public/sz%C3%A9n.jpg?itok=te4O-xfz)